Ácidos: Polihidratados
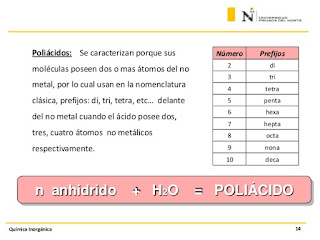
Ácidos Polihidratados Son aquellos que resultan de la combinación de un anhídrido y varias moléculas de agua. Los óxidos de ciertos no metales pueden combinarse con más de una molécula de agua, para diferenciarlos se utilizan los prefijos: meta, piro, orto, según la siguiente tabla: Prefijo Para elemento con valencia impar Para elemento con valencia par Meta 1 anhidrido+1 H2O 1 anhídrido + 1 H2O Piro 1 anhidrido+2 H2O 2 anhídrido + 1 H2O Orto 1 anhidrido+3 H2O 1 anhídrido + 2 H2O ÁCIDOS POLIHIDRATADOS Los Polihidratados se forman de un oxido acido + nH2O =====> Acido Polihidratado El prefijo meta indica que ha adicionado una molécula de H2O y el prefijo orto que ha adicionado el mayor número de moléculas de H2O. Para el fósforo, el arsénico y el boro son tres moléculas de agua y para el silicio dos: P2O3 + H2O H2P2O4 H